V. 14. No.2 junio-agosto 2024
ISSN: 2306-823X
Recibido: 3/01/2024/Aceptado: 25/03/2024
Evidencia de dosis que afectan el potencial eléctrico mediante un simulador de axón gigante de calamar
Evidence of doses affecting electrical potential using a giant squid axon simulator
Consuelo González-Dávila Boy cgdb1501@gmail.com (1)
Valeria González Galdós gonzalezvaleria398@gmail.com (1)
Isaac A. Morales Soto isaac.arturo.morales.soto@gmail.com (1)
Axel Paredes Martínez axel.paredes.enp5.28@gmail.com (1)
Karla Sampayo Vicente karlasampayovicenteg3@gmail.com (1)
(1) Universidad Nacional Autónoma de México, México
Resumen: Se observaron los cambios en el potencial de acción del axón gigante de calamar a partir de diferentes dosis de tetrodotoxina utilizando el programa de simulación de experimentos virtual Nerve. Se replicaron resultados obtenidos en investigaciones previas en el modelo axón gigante de calamar. Se obtuvo evidencia acerca de las dosis efectivas de la tetrodotoxina en el axón del calamar gigante. Los resultados indican que las afectaciones derivadas de la presencia extracelular de tetrodotoxina se ven reflejadas los gráficos de los resultados, por el efecto retardado de los potenciales de acción en el tiempo dependiendo de la dosis administrada.
Palabras clave: zombies, canales de sodio, neurotoxina, téutidos, moluscos cefalópodos
Abstract: Changes in the action potential of the squid giant axon were observed from different doses of tetrodotoxin using the virtual experiment simulation program Nerve. Results obtained in previous research were replicated in the squid giant axon model. Evidence was obtained about the effective doses of tetrodotoxin in the axon of the giant squid. The results indicate that the effects derived from the extracellular presence of tetrodotoxin are reflected in the graphs of the results, due to the delayed effect of the action potentials over time depending on the dose administered.
Keywords: zombies, sodium channels, neurotoxin, teutids, cephalopod mollusks
Introducción
Gran parte del interés por la tetrodotoxina (TTX) surge a partir de las investigaciones que realizó Wade Davis en Haití en la década de 1980. Davis (1983) se basó en los casos de zombificación que estaban ocurriendo en este lugar, por lo que recolectó 8 muestras del polvo zombie en los cuales se encontró pequeñas cantidades de TTX (Booth, 1988; Inglis, 2010). Davis propone que la substancia responsable del fenómeno zombie es la TTX, teoría que generó controversia en la comunidad científica en los años 80 del siglo XX y varias publicaciones tuvieron el objetivo de contrarrestar la propuesta de Davis (Anderson, 1988; Benedek & Rivier, 1989).
La tetrodotoxina es una neurotoxina potente que se encuentra en los órganos de múltiples especies marinas y algunas especies terrestres; especialmente en el hígado, los ovarios y la piel (Ban et al., 2014). Varios ensayos han demostrado que la TTX y sus sustancias análogas en especies marinas son producidos por una multitud de especies bacterianas relacionadas a ciertos huéspedes, como Vibrio, Bacillus, Aeromonas, Shewanella, Alteromonas y Pseudomonas, que habitan naturalmente en el intestino de los animales (Ban et al., 2014; Pratheepa et al., 2016).
En Japón existe un platillo costoso llamado Fugu (pez globo) lo preparan chefs expertos certificados en el manejo del peligroso pez. Los comensales que consumen este platillo indican que lo hacen por las sensaciones de adormecimiento que produce su ingesta. Por otro lado, se indica que el comer este tipo de animales que contienen la TTX puede producir consecuencias graves ya que el tóxico afecta a la transmisión nerviosa y la contracción muscular (Field-Cortazares, Calderón-Campos & Seijo, 2009).
La TTX aislada es un fármaco que ha servido para conocer que sucede cuando no entran las substancias requeridas para que la neurona responda, en experimentos de laboratorio a nivel de las neuronas. La neurona está compuesta de tres partes: cuerpo celular o soma, axón y dendritas. El axón se encarga de la transmisión del impulso eléctrico (o de transmitir los mensajes entre las neuronas del cerebro).
Al administrar TTX se observa su capacidad de bloquear los canales de sodio de los axones de los calamares (Sevcik, 1976). Esta neurotoxina obstruye los canales de sodio dependientes de voltaje (NaV) en los tejidos nerviosos y musculares, lo que provoca la inhibición de la propagación de los potenciales de acción y paraliza la función nerviosa y muscular (Lee y Ruben, 2008). Por lo tanto, la TTX inhibe la fase temprana de la corriente iónica independientemente de su dirección o de la naturaleza del transportador. Se ha concluido que la TTX actúa específicamente sobre el mecanismo del aumento temprano de la permeabilidad iónica de la membrana (Moore et al., 1967 citado por Cuervo, 1970).
Los canales de sodio dependientes de voltaje (NaV) son un tipo de proteínas transmembranales que se encargan de regular el flujo de sodio a través de la membrana de una célula. La activación de NaV es un factor clave para la excitabilidad de la membrana ya que la apertura de los canales permite que los iones de sodio se dispersen al interior de la célula, iniciando la fase ascendente del potencial de acción (AP) (Lee y Ruben, 2008).
Acerca del axón del calamar gigante, Hodgkin y Huxley (1952) estudiaron el mecanismo iónico de la generación y propagación del potencial de acción. Para la realización de sus investigaciones hubo dos elementos esenciales: equipo electrónico y la particular anatomía del calamar. Cole y Marmont (1968) desarrollaron voltage-clamp equipo para el control de potencial de membrana celular que permite mantener el potencial de membrana cuando la célula es estimulada, evitando el fenómeno explosivo –todo o nada– del potencial de acción. El otro elemento importante fue el axón gigante de calamar el cual posee axones de gran diámetro que en algunas especies llegan a tener cerca de 1 mm, esto permite a los electrofisiólogos “insertar a lo largo del axón electrodos metálicos para registro e inyección de corriente, exprimir el axoplasma y cambiar la composición del medio intracelular” (Kotsias, 2004).
El objetivo de este escrito fue comprobar las dosis efectivas de tetrodotoxina en un simulador de axón gigante de calamar.
Uno de los principales usos farmacéuticos de la TTX es la fabricación de medicamentos analgésicos que ayudan a combatir tanto el dolor producido por algún tipo de lesión como el dolor neuropático. La tetrodotoxina también se usa como antiinflamatoria, como medicamento en desintoxicación de pacientes adictos a la heroína y reducción de metástasis del cáncer (Gomes et al., 2011).
Aunque la generalidad de los resultados actuales debe ser establecida por investigaciones futuras, el presente estudio brindado un soporte para la investigación de las dosis efectivas de tetrodotoxina en células nerviosas. Apoyando, además, las investigaciones sociales y neurobiológicas de la tradición haitiana tergiversada por datos previos que gozaron de laxidad (Inglis, 2010).
Materiales y métodos
Se utilizó el Simulador Nerve (http://nerve.bsd.uchicago.edu/nervejs/MAP1.html), que mide el alcance de la acción de TTX determinado por medio de la técnica de fijación de voltaje (Figura 1). Como la TTX actúa específicamente sobre el canal de sodio, la atención se centra en los cambios en la corriente máxima de entrada de sodio en un estado dado de la membrana en función de la TTX, el tiempo y la temperatura.
Figura 1. Menú principal de la página Nerve donde se realizó la práctica (http://nerve.bsd.uchicago.edu).
Dentro de la página, en el apartado de membrane action potential o potencial de acción de membrana, se activó la opción de “concentrations” en el menú que se muestra en la parte superior derecha de la página. De esta forma, se reveló un menú más pequeño en la parte inferior derecha en el cual se modificaron las concentraciones de TTX para cumplir con el objetivo de la práctica. Al alterar la variable de concentración (en nM) la gráfica que reflejaba el potencial de membrana se afecta. En la figura 2 se presenta la gráfica de control que no muestra modificación de la página Nerve donde se analizaron los potenciales de membrana.
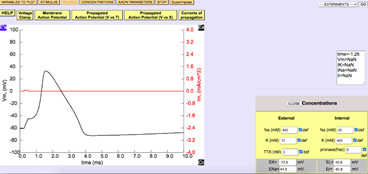
Figura 2. Sección de la página Nerve donde se analizaron los potenciales de membrana.
Procedimiento
Para llevar a cabo los ensayos se ingresó a la página de Nerve seleccionando la opción de potencial de acción de membrana (Membrane Action Potetial) y, posteriormente, la opción de concentraciones para que apareciera el menú amarillo de la parte inferior derecha de la pantalla. De esta forma, se fueron modificando los valores de la concentración de TTX y se fueron registrando las variaciones que estos cambios tenían sobre el potencial de acción del axón del calamar gigante. En los casos en los que la diferencia entre un valor de concentración y otro era mínimo, casi imperceptible, se activó la opción de “superponer” en la cual la gráfica conservaba el dato del valor seleccionado anteriormente y permitía hacer comparaciones visuales sobre aquellas diferencias. Por último, se guardaron las gráficas para un análisis posterior.
Resultados
Se realizaron un total de cinco ensayos con distintas concentraciones de TTX para contrastar las dosis mínimas y máximas en las que sería operante un cambio efectivo en el potencial de acción de los axones del calamar gigante. Para estudiar los efectos inhibitorios de la TTX se decidió emplear un rango de concentración más amplio al encontrado en algunos artículos científicos que tuvieron objetivos similares.
En la figura 3 se observan las diferentes dosis de TTX usadas en el simulador de axón gigante de calamar; la máxima concentración encontrada donde se dejan de percibir cambios, fue de 50 nM. De manera similar, a pesar de que Sevcik (1976) encontró que la concentración mínima en la cual se empieza a notar un cambio en el potencial de membrana era de 0,1 nM, nuestras estimaciones y experimentos arrojaron que a partir de 0,02 nM se empieza a presentar el cambio.
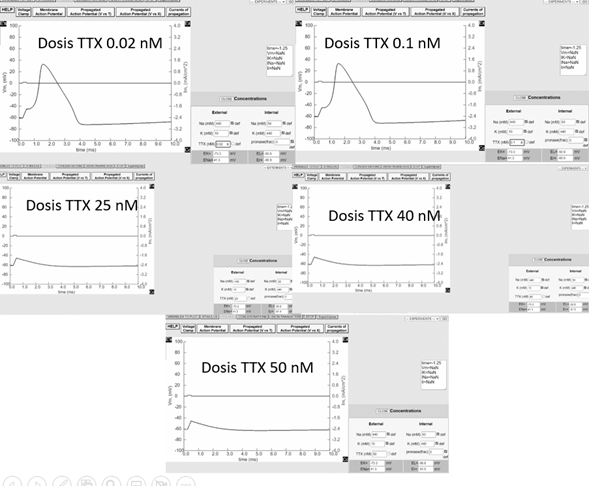
Figura 3. Gráficos del trazo del potencial de acción en el axón gigante de calamar con diferentes dosis de TTX.
Discusión
Debido a la histórica polémica de la propuesta de Davis acerca de que las pociones de los brujos vudú de Haití contiene TTX y esta neurotoxina es la responsable del fenómeno de zombificación y aunado a esto la evidencia que indica los efectos sobre el organismo humano que tiene esta substancia, quisimos hacer un experimento para comprobar los efectos de la TTX en el modelo de axón gigante de calamar en un programa que podía simular dicho axón con manipulación de diferentes dosis de la TTX.
Estudios previos usando concentraciones entre 15-25 nM (Cuervo, 1970), mostraron un rápido comienzo del efecto de la TTX bloqueando la excitabilidad del axón. Cuervo encontró que concentraciones entre 1-15 nM no bloquean totalmente la corriente de sodio, por lo que estableció el valor inhibitorio total en 25 nM. Por otro lado, la máxima concentración encontrada por Sevcik (1976) fue de 50 nM.
Una interpretación de estos hallazgos es que se menciona que los canales de sodio en la membrana del axón del calamar poseen dos tipos de receptores para la TTX. El tipo 1 cuenta con afinidad constante de 0,11 ± 0.05 nM, mientras que el tipo 2 tiene afinidad constante de 4,9 ± 0.49 nM, por lo que el segundo tipo es evidenciado con mayor facilidad al estudiarse el TTX con un rango de concentración de 1 a 25 nM mientras que el tipo 1 posee una mayor afinidad con la TTX y se activa con rangos superiores a 25 nM (Sevcik, 1976).
En este escrito se buscó replicar las investigaciones que otros autores habían realizado acerca de las dosis de TTX que genera cambios en el axón gigante de calamar relacionados con la inhibición de canales de sodio. En la investigación previa de Sevcik (1976) se realizó un experimento en el cual se determinaron dos tipos de medidas. En la primera, la toxina se aplicó comenzando por concentraciones bajas desde 0,1 nM hasta 50 nM y se midió la supresión de sodio después de 15 minutos de exposición a la concentración con la toxina.
En conjunto, estos hallazgos indican que la medida mínima para que se presente un cambio en el potencial de acción es de 0,02 nM. Por otra parte, de acuerdo con Tasaki (1978), a una concentración final de aproximadamente 50 nM la TTX suprimió rápidamente las respuestas habiendo una caída rápida en la amplitud del potencial de acción, acompañada por un acortamiento de su duración. Sin embargo, se encontró que no es hasta que las concentraciones adquieren un valor de 40 nM, que se observan los efectos descritos por los autores. Estos hallazgos nos permiten teorizar que la dosis donde ya no se observan respuestas en el potencial de acción se encuentra, de hecho, en los 40 nM.
Conclusiones
Se obtiene evidencia acerca de las dosis efectivas de la tetrodotoxina en el axón del calamar gigante. Se han descrito dichos cambios debido al efecto inhibitorio de la TTX en los canales de sodio, resultando en la afección de su corriente y por lo tanto de la propagación de los potenciales de acción. En conjunto, los resultados indican que las afectaciones derivadas de la presencia extracelular de TTX se ven reflejadas los gráficos de los resultados, por el efecto retardado de los potenciales de acción en el tiempo dependiendo de la dosis administrada de la droga. De este modo, en las mismas imágenes se pueden observar disminuciones en el voltaje alcanzado en el pico de la membrana como resultado de la modificación de las corrientes iónicas en presencia de TTX, en donde la corriente correspondiente al sodio se observa sumamente disminuida ante la presencia de la droga, mientras que la corriente de potasio no se ve afectada.
Una explicación adicional merece un comentario. Por ejemplo, diversas investigaciones han sugerido que las dosis efectivas se encuentran en el rango de 0,1 nM (Sevcik, 1976) a 50 nM (Tasaki, 1978). Esta práctica es un primer intento de abordar estos problemas, pues consideramos que una mayor investigación vigente acerca de las dosis efectivas puede aclarar los resultados dispares citados en artículos previos y los encontrados en la investigación reciente.
Una limitación y detalle importante a considerar sobre este estudio es que fue realizado de manera virtual. Es posible que la naturaleza misma de la experimentación haya influido en la exactitud de los resultados encontrados comparados con aquellos realizados hace más de 30 años. Aunque la presente investigación no puede descartar estas explicaciones, parece útil señalar cuestiones que pueden entrar en conflicto con estos resultados.
A pesar de estas limitaciones, estos datos tienen algunas intervenciones de potencial trascendencia. Algunas de las aplicaciones más destacables de los resultados obtenidos se relacionan a la industria farmacéutica. La capacidad de inhibir los canales de sodio (Na+) pero no afectar a la permeabilidad de los canales de potasio (K+), ha ayudado a establecer la masa y la forma de estos canales.
En cuanto a futuras investigaciones, sería útil extender los hallazgos actuales examinando modelos animales no virtuales. Desde los años que se realizaron los estudios citados (1976 y 1978), las investigaciones y el conocimiento acerca de la tetrodotoxina y sus efectos en el cuerpo humano han avanzado mucho. Hacer este experimento hoy en día con modelos animales, también nos lleva a reconsiderar las cantidades máximas y mínimas a partir de las cuales se nota un efecto en el potencial de acción del axón del calamar, así como poder ligar los resultados encontrados con otras investigaciones dentro de las neurociencias. La tecnología actual puede permitir complementar y comparar los resultados obtenidos por investigadores en el siglo pasado, obteniendo mediciones de mayor exactitud en modelos no virtuales del axón del calamar gigante.
Referencias bibliográficas
Anderson, W. H. (1988). Tetrodotoxin and the zombi phenomenon. Journal of ethnopharmacology, 23(1), 121-126. doi:10.1016/0378-8741(88)90122-5
Bane, V., Lehane, M., Dikshit, M., O’Riordan, A., & Furey, A. (2014). Tetrodotoxin: Chemistry, toxicity, source, distribution and detection. Toxins, 6(2), 693-755. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3942760/
Benedek, C., Rivier, L. (1989). Evidence for the presence of tetrodoxin in a powder used in Haiti for zombification. Toxicon, 27, 473-480. https://doi.org/10.1016/0041-0101(89)90210-9
Booth, W. (1988). Voodoo science: a popular claim that a chemical found in puffer fish may be a crucial element in the creation of the zombies of Haitian folklore has been challenged; critics claim contrary evidence was ignored. Science, 240(4850), 274-277. https://www.science.org/doi/abs/10.1126/science.3353722
Cole K. S. (1968). Membranes ions and impulses. Berkeley, University of California Press.
Cuervo, L. A. (1970). Equilibrium and Kinetic Properties of the Interaction between Tetrodotoxin and the Excitable Membrane of the Squid Giant Axon. The Journal of General Physiology, 55(3), 309–335. https://doi.org/10.1085/jgp.55.3.309
Davis, E. W. (1983). The ethnobiology of the Haitian zombi. Journal of ethnopharmacology, 9(1), 85-104. https://doi.org/10.1016/0378-8741(83)90029-6Get
Field-Cortazares, J., Calderón-Campos, R., & Seijo, J. L. (2009). Envenenamiento por pez globo. Boletín Clínico Hospital Infantil del Estado de Sonora, 26(1), 28-32. https://www.medigraphic.com/pdfs/bolclinhosinfson/bis-2009/bis091f.pdf
Gomes, A. P., Dos Santos, A., Ambrósio, C. E., & Ribeiro, M. O. (2011). Emprego terapêutico da tetrodotoxina em organismos animais. Acta Veterinaria Brasilica, 5(4), 343–350. https://pesquisa.bvsalud.org/portal/resource/pt/biblio-1414593
Hodgkin A, Huxley A. (1952) Quantitative description of membrane current and its application to conduction and excitation in nerve, J. Physiol, 117, 500-544.https://doi.org/10.1113/jphysiol.1952.sp004764
Inglis, D. (2010). The zombie from myth to reality: Wade Davis, academic scandal and the limits of the real. Scripted, 7, 351. https://heinonline.org/HOL/Page?handle=hein.journals/scripted7&div=35&g_sent=1&casa_token
Kotsias, B. A. (2004). El axón gigante de calamar. Medicina (Buenos Aires), 64(3), 273-276. http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0025-76802004000300017
Lee, C. & Ruben, P. (2008). Interaction between voltage-gated sodium channels and the neurotoxin, tetrodotoxin. Channels, 2(6), 407-412. https://doi.org/10.4161/chan.2.6.7429
Pratheepa V., Alex A., Vasconcelos M. (2016). Análisis de diversidad bacteriana y tetrodotoxinas en las vísceras de los gasterópodos de las costas portuguesas. Toxicon 19, 186-193. https://aac-europe.org/wp-content/uploads/2018/06/AAC-MACRecommendation-TTXES.pdf
Sevcik, C. (1976). Binding of tetrodotoxin to squid nerve fibers. Two kinds of receptors? The Journal of General Physiology. https://doi.org/10.1085/jgp.68.1.95
Tasaki, I. (1978). Further Studies of Periodic Miniature Responses in Squid Giant Axons. Jap. J. Physiol 28, 89–108. https://doi.org/10.2170/jjphysiol.28.89